L’amélioration de la sensibilité à l’insuline après transplantation de microbiote fécal dépend de la composition initiale du microbiote des receveurs
Article commenté - rubrique adulte
Par le Pr. Harry Sokol
Service de gastro-entérologie et nutrition, Hôpital Saint-Antoine, Paris, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Commentaire de l’article original de Kootte et al. ( Cell Metab 2017)
Le microbiote intestinal est impliqué dans l’insulinorésistance bien que les preuves concernant le lien de causalité soient limitées. Nous avons comparé l’effet d’une transplantation de microbiote fécal (TMF) provenant d’un donneur mince (allogénique) à celui d’une autotransplantation (autologue) chez des patients de sexe masculin avec syndrome métabolique. Alors qu’aucun changement métabolique n’a été observé à 18 semaines après TMF, la sensibilité à l’insuline était significativement améliorée à 6 semaines dans le groupe TMF allogénique et cela était associé à une modification de la composition du microbiote. Nous avons aussi rapporté des changements dans les concentrations de métabolites plasmatiques comme l’acide γ-aminobutyrique et montré que la réponse métabolique après TMF (définie comme l’amélioration de la sensibilité à l’insuline 6 semaines après TMF) s’observe chez les patients ayant une diversité microbienne réduite à l’état basal. En conclusion, les effets bénéfiques de la TMF de donneurs minces sur le métabolisme glucidique sont associés à des changements du microbiote intestinal et des métabolites plasmatiques et peuvent être prédits par la composition basale du microbiote du receveur. [4]
Que sait-on déjà à ce sujet ?
L’obésité et les pathologies qui y sont reliées comme le diabète nécessitent de nouvelles approches thérapeutiques car les traitements actuels comme les modifications du mode de vie et les traitements antidiabétiques sont insuffisamment efficaces pour réduire la morbidité et la mortalité. Pendant la dernière décennie, les changements dans la composition du microbiote intestinal ont émergé comme une nouvelle stratégie thérapeutique potentielle pour améliorer la sensibilité à l’insuline [1]. Plusieurs études ont montré que la composition du microbiote intestinal est différente entre animaux minces et obèses, mais aussi que la composition microbienne pourrait être le reflet de fonctions métaboliques altérées avec notamment une perturbation des aliments ingérés [2]. Finalement, ces études chez l’animal ont suggéré un lien causal entre les anomalies du microbiote et le syndrome métabolique puisque le phénotype est transférable par TMF [2]. Bien que de nombreuses études observationnelles aient suggéré des corrélations entre une composition altérée du microbiote et le métabolisme chez l’homme, la causalité a été difficile à prouver. Les auteurs de la présente étude ont montré précédemment dans une petite étude pilote que la TMF de donneur mince à des hommes avec syndrome métabolique induisait une amélioration du métabolisme glucidique, parallèlement à des changements du microbiote fécal et duodénal [3]. Ces résultats ont poussé les auteurs à étudier les effets à court et long termes de la TMF de donneur mince sur la composition du microbiote intestinal dans un groupe plus grand d’hommes avec syndrome métabolique et à explorer la physiopathologie de l’insulinorésistance en corrélant les changements du microbiote intestinal à plusieurs marqueurs du métabolisme. De plus, les auteurs ont tenté d’identifier les caractéristiques basales du microbiote des receveurs permettant d’expliquer l’amélioration de l’insulinosensibilité chez certains patients (appelés répondeurs métaboliques) et pas chez d’autres (non répondeurs).
Points clés
-
La TMF provenant de donneur mince améliore l’insulinosensibilité de patients obèses avec syndrome métabolique
-
Il existe une variabilité interindividuelle dans la réponse et celle-ci est transitoire
-
L’amélioration de l’insulinosensibilité est reliée à des changements de métabolites plasmatiques
-
La réponse à la TMF est dépendante de la composition initiale du microbiote des patients
Quels sont les principaux résultats apportés par cette étude ?
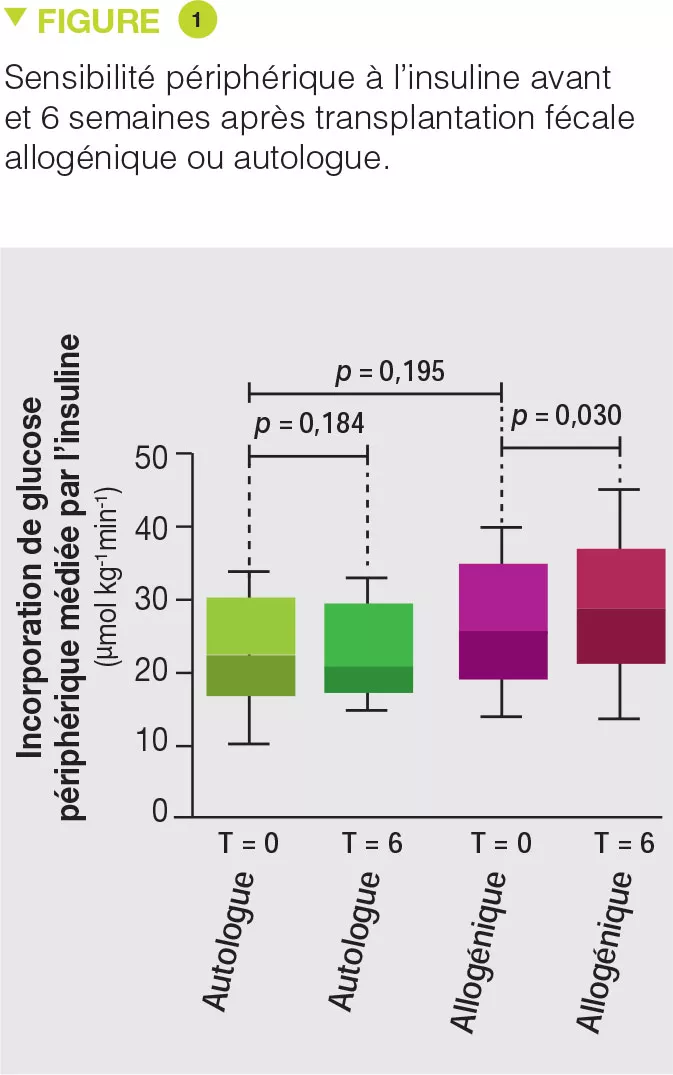
Trente-huit hommes obèses avec syndrome métabolique ont été inclus et randomisés dans le groupe TMF allogénique (n = 26) ou autologue (n = 12). La TMF était réalisée par sonde nasoduodénale et répétée 6 semaines plus tard. Dix-huit semaines après la TMF, aucun effet n’était observé, ni sur le microbiote ni sur les paramètres du syndrome métabolique. En revanche, 6 semaines après la TMF, le microbiote du groupe TMF allogénique était modifié et les paramètres métaboliques et particulièrement l’insulinosensibilité étaient améliorés alors qu’aucun changement n’était observé dans le groupe TMF autologue (Figure 1). Contrairement à leur étude précédente, aucun changement dans la concentration de butyrate fécale n’a été observé [3]. En revanche, la TMF allogénique était associée à une augmentation de la concentration d’acétate fécal ainsi qu’à des modifications du taux d’une trentaine de métabolites sanguins dont plusieurs impliqués dans le métabolisme du tryptophane. Dans le sous-groupe des patients ayant répondu favorablement à la TMF allogénique, des changements ont été observés dans le microbiote fécal comme, par exemple, une augmentation de la bactérie Akkermansia muciniphila dont les effets favorables sur le syndrome métabolique ont été démontrés chez la souris. Les auteurs ont également mis en évidence que la composition basale du microbiote ainsi qu’une diversité faible étaient prédictives de la bonne réponse à la TMF.
Quelles conséquences en pratique ?
Les interventions sur le microbiote intestinal, et particulièrement la TMF, sont une piste thérapeutique valable dans le syndrome métabolique. Néanmoins, il existe une forte variabilité interindividuelle dans la réponse, pouvant être liée à des facteurs de l’hôte mais aussi du donneur. Par ailleurs, les effets sont relativement modestes avec une TMF unique et, au mieux, ils sont transitoires. Des stratégies plus ciblées, comme l’utilisation de probiotiques de nouvelle génération (bactéries issues du microbiote), et avec une administration prolongée sont donc plus attractives et sont actuellement à l’étude.
Conclusion
Cette étude interventionnelle démontre que le microbiote intestinal est bien un acteur du syndrome métabolique et pas seulement un témoin passif. Les mécanismes impliqués pourraient passer par la production de métabolites par le microbiote intestinal modulant les voies de signalisation de l’hôte. Néanmoins, les effets sont relativement modestes et transitoires. Des stratégies plus ciblées, comme l’utilisation de probiotiques de nouvelle génération, et avec une administration prolongée, sont donc plus attractives et sont actuellement à l’étude.






