Дети и подростки с синдромом дефицита внимания и гиперактивностью, а также расстройствами аутистического спектра имеют разный состав микробиоты
КОММЕНТАРИИ К СТАТЬЕ - Раздел, посвященный детям
Проф. Эммануэль Мас (Emmanuel Mas)
Отделение гастроэнтерологии и нутрициологии, Детская больница, Тулуза, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Отделение гастроэнтерологии и нутрициологии, Детская больница, Тулуза, Франция
Была высказана гипотеза о связи между изменениями кишечной микробиоты и синдромом дефицита внимания и гиперактивности (СДВГ), а также расстройствами аутистического спектра (РАС). Авторы проанализировали состав кишечной микробиоты у детей и подростков с наличием или отсутствием этих расстройств с точки зрения системных эффектов бактерий. Исследуемая группа состояла из пациентов с диагнозами СДВГ, РАС и СДВГ/РАС, а контрольные — из их братьев/сестер и неродственных детей. Кишечную микробиоту анализировали путем секвенирования гена 16S рРНК в области V4, а также определяли концентрацию липополисахаридсвязывающего белка (ЛСБ), цитокинов и других сигнальных молекул в плазме. Важно отметить, что состав кишечной микробиоты у детей с СДВГ и РАС был очень схожим с точки зрения альфа- и бета-разнообразия, отличаясь от состава микробиоты у неродственных детей. В подгруппе участников с СДВГ и РАС отмечалась повышенная концентрация ЛСБ по сравнению со здоровыми детьми, что положительно коррелировало с уровнями интерлейкинов (ИЛ)-8, 12 и 13. Эти наблюдения указывают на нарушение кишечного барьера и иммунную дисрегуляцию у детей с СДВГ или РАС.
Что мы уже знаем?
Синдром дефицита внимания с гиперактивностью (СДВГ) и расстройство аутистического спектра (РАС) представляют собой нарушения развития нервной системы. У детей с СДВГ и РАС часто возникают желудочно-кишечные нарушения, такие как боль в животе и запор. Причина этих расстройств кроется в генетических нарушениях в сочетании с действием факторов риска внешней среды, особенно характера питания. По этой причине наряду с медикаментозной терапией можно предложить диетическое вмешательство, поскольку состав кишечного микробиома имеет важное значение для функционирования оси кишечник — головной мозг. Также мы знаем, что дети с РАС часто едят определенные виды пищи, что может объяснить изменение кишечной микробиоты. Кроме дисбиоза, при СДВГ и РАС описано увеличение кишечной проницаемости и системное воспаление низкой степени. Цель этого исследования состояла в том, чтобы проанализировать изменения кишечной микробиоты у пациентов с СДВГ, РАС и СДВГ/РАС по сравнению с их здоровыми братьями и сестрами и неродственными детьми. Вторичные цели заключались в оценке кишечной проницаемости и иммунной системы.
Что главное в этом исследовании?
В общей сложности 95 детей в возрасте 5-17 лет, включая 32 ребенка с СДВГ, 12 детей с РАС, 11 детей с СДВГ/РАС, 14, 5, 4 братьев и сестер пациентов и 17 неродственных детей. Желудочно-кишечные нарушения включали запор: СДВГ 15,6% (братья и сестры 7,1%), РАС 8,3% (братья и сестры 0%), СДВГ/РАС 18,2% (братья и сестры 0%), неродственные дети 5,9%; боль в животе: СДВГ 3,1% (братья и сестры 0%), РАС 16,7% (братья и сестры 0%), СДВГ/ РАС 18,2% (братья и сестры 0%), неродственные дети 0%; и реже — гастроэзофагеальный рефлюкс. Атипичная диета была наиболее распространена среди детей с РАС (50%), что было связано с однообразной пищей.
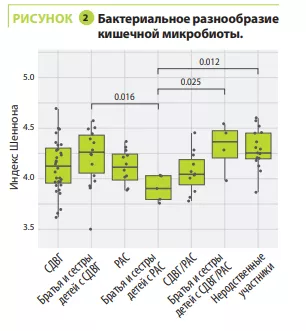
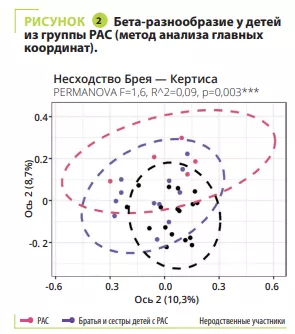
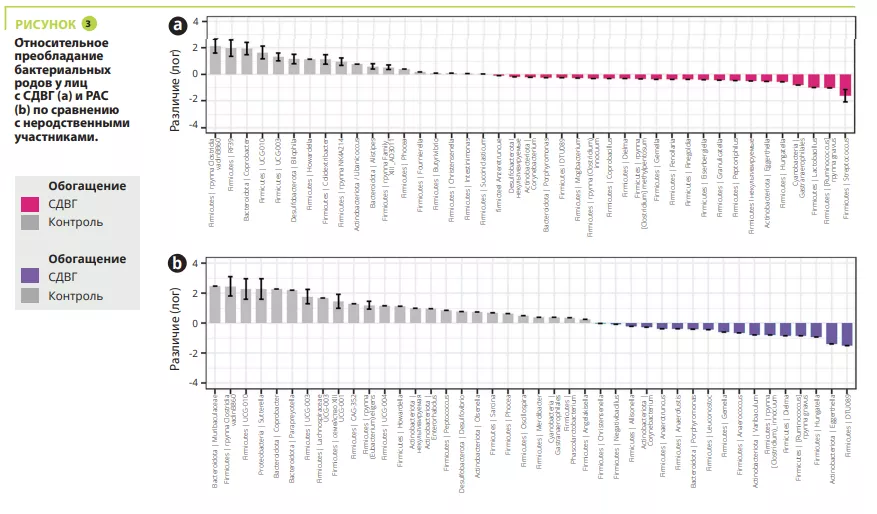
Анализ микробиоты кишечника не выявил каких-либо различий в альфа-разнообразии между участниками с СДВГ, РАС, СДВГ/РАС, их родственниками или неродственными детьми; напротив, оно было значимо ниже у братьев и сестер с РАС (рисунок 1). С точки зрения бета-разнообразия состав кишечной микробиоты был очень схожим у детей с СДВГ и РАС, значимо отличаясь между детьми с СДВГ, РАС и неродственными детьми (рисунок 2). В микробиоте некоторых детей с СДВГ, РАС или СДВГ/РАС содержалось меньше представителей типа Bacteroidetes и больше — Actinetobacteria. Во всех группах преобладали роды Bacteroides, Faecalibacterium, Blautia и Bifidobacterium; у некоторых детей наблюдалось высокое содержание Prevotella. Различия в численности родов бактерий были обнаружены между детьми с СДВГ, РАС и контрольной группой (рисунок 3), но не между детьми с СДВГ и РАС.
Между всеми исследуемыми и контрольными группами отсутствовали какие-либо различия по уровням фекального кальпротектина и ЛСБ. Однако корреляция между уровнями фекального кальпротектина и ЛСБ и бактериальным альфаи бета-разнообразием отсутствовала. Результаты измерения различных цитокинов и хемокинов не показали значимых различий между группами. Однако у нескольких детей с СДВГ и РАС уровни IL1-RA были выше по сравнению с неродственными детьми, а у 5 детей с СДВГ и одного ребенка с РАС концентрации IFN-g были выше, чем у неродственных детей. Наконец, были обнаружены слабо положительные корреляции между уровнями ЛСБ и ИЛ-8 (р=0,023), ИЛ-12 (р=0,018), ИЛ-13 (р=0,035) и PlGF (р=0,045), что позволяет предположить роль нарушений барьерной функции кишечника и иммунной регуляции.
- Подтверждено изменение кишечной микробиоты при нарушениях развития нервной системы, таких как СДВГ и РАС. Нарушения кишечной микробиоты и увеличение кишечной проницаемости, вероятно, связаны с системным воспалением низкой степени.
Каковы практические последствия?
Это исследование включало небольшое число участников, в первую очередь родственных контролей. Кишечная микробиота, а также кишечная проницаемость могут быть значимыми мишенями для терапевтического вмешательства у детей и подростков с СДВГ и РАС.
ЗАКЛЮЧЕНИЕ
Дети и подростки с СДВГ и РАС имели похожую кишечную микробиоту, отличную от таковой у неродственных участников контрольной группы. Различия в бета-разнообразии кишечной микробиоты и повышение уровня ЛСБ ассоциировались с различными концентрациями системных про- и противовоспалительных молекул.

