Cibler le microbiote intestinal pour lutter contre l’allergie
Synthèse
Par le Pr. Roberto Berni Canani, MD, PhD
Département des sciences médicales translationnelles ; Laboratoire européen pour l’étude des maladies d’origine alimentaire et les biotechnologies de pointe du CEINGE ; Groupe de travail sur l’étude du microbiote intestinal, Université de Naples Federico
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Le microbiote intestinal (MI) dysbiotique joue un rôle important dans le développement des maladies allergiques, notamment alimentaires (AA). Le MI induit la maturation et le fonctionnement du système immunitaire ; or des facteurs génétiques, environnementaux et alimentaires peuvent modifier le microbiote commensal, ce qui provoque un dérèglement de la fonction immunitaire. Plusieurs facteurs responsables de la dysbiose ont été associés à la survenue d’allergies, tels que l’accouchement par césarienne, l’absence d’allaitement maternel, l’utilisation de médicaments (surtout antibiotiques et inhibiteurs de la pompe à protons) ainsi que l’usage d’agents antiseptiques et des régimes alimentaires à faible teneur en fibres et riches en graisses. Aucun taxon bactérien spécifique n’a été relié de manière systématique aux allergies, mais il a été insinué que la dysbiose intestinale se produit avant même que les allergies ne soient présentes. Les acides gras à chaîne courte (AGCC) sont des métabolites essentiels dérivés du MI, impliqués dans les interactions avec le système immunitaire. Cibler la composition et la fonction du MI représente ainsi une stratégie prometteuse pour lutter contre les maladies allergiques, en particulier contre les AA dans l’enfance.
La prévalence, la persistance et la sévérité des maladies allergiques, notamment des AA, ont considérablement augmenté ces dernières décennies dans les pays industrialisés, sous la pression des interactions entre les gènes et l’environnement, conduisant à un dysfonctionnement du système immunitaire, médié, au moins en partie, par des mécanismes épigénétiques [1, 2]. Cette évolution a entraîné une augmentation des hospitalisations, des visites médicales, des traitements et de la charge en soins pour les familles. Tous ces facteurs, qui ont un retentissement significatif sur les coûts engendrés et la qualité de vie, imposent un lourd fardeau psychologique aux patients et à leur entourage. Les AA sont caractérisées par une réponse immunitaire anormale vis-à-vis des peptides antigéniques alimentaires qui sont normalement tolérés.
La cause de celles-ci est encore mal définie. D’après les connaissances actuelles, la susceptibilité génétique ne peut, à elle seule, expliquer l’évolution des AA, et le rôle de l’environnement dans la sensibilisation aux aliments suscite un regain d’intérêt. Des études suggèrent une fonction pathogénétique clé des altérations du MI dans le développement des allergies : un MI sain a un impact crucial sur le développement du tractus gastrointestinal et du système immunitaire ; un MI dysbiotique est lié à diverses maladies, y compris aux allergies [3].
Valeur de l’exposition microbienne pour la tolérance immunitaire
La manière dont les antigènes alimentaires sont normalement rendus non immunogènes, par le biais de la tolérance immunitaire, n’a pas encore été entièrement définie. Des travaux évoquent un rôle pivot des lymphocytes T régulateurs (Treg) exprimant le facteur de transcription Foxp3 (Foxp3+ Treg) et de l’interaction complexe entre le MI et les cellules immunitaires ou non immunitaires. La présence de populations de cellules Treg induite par l’alimentation et par les microbes est nécessaire pour une tolérance complète des antigènes alimentaires [4].
Lors d’un accouchement par voie basse, les nourrissons reçoivent leur premier inoculum bactérien du tractus vaginal, du tissu cutané et souvent de la matière fécale de la mère, exposant le système immunitaire immature à une charge bactérienne substantielle [3]. La maturation d’un MI sain au début de la vie permet une variation de l’équilibre Th1/Th2, ce qui favorise une réponse cellulaire de type Th1, tandis que la dysbiose altère l’homéostasie du microbiote de l’hôte, ce qui déséquilibre les cytokines vers une réponse de type Th2 [5].
Le nombre de cellules Treg est réduit chez les souris dépourvues de germes et celles recevant une alimentation à base d’acides aminés [4, 6]. Les immunoglobulines de type A (IgA) sécrétoires et les peptides de l’immunité innée exercent une fonction capitale dans la régulation de la composition du MI. Une déficience de l’immunité innée et adaptative (en particulier un faible taux d’IgA) a été observée chez des enfants présentant de multiples AA [7]. Un MI sain, renforçant la production d’IgA sécrétoires, facilite la survie des souches bactériennes protectrices dans la lumière intestinale [8].
Microbiote intestinal et allergies
L’expression d’un phénotype allergique dépend de l’interaction entre deux facteurs principaux : la prédisposition génétique et les interactions gènes-environnement. Un nombre croissant d’études révèlent une corrélation entre les facteurs qui perturbent le MI pendant l’enfance et le développement d’allergies plus tard dans la vie. De plus en plus de travaux montrent qu’une dysbiose du MI en début de vie représente un facteur critique qui sous-tend le développement des allergies.
Les principaux facteurs responsables de la dysbiose sont : la naissance par césarienne, l’absence d’allaitement maternel, l’usage de médicaments (principalement antibiotiques et inhibiteurs de la pompe à protons) ainsi que d’agents antiseptiques, le moment de la diversification alimentaire, et les régimes alimentaires à base de malbouffe et/ou à faible teneur en fibres/ riches en graisses [3, 9]. L’utilisation d’antibiotiques par la mère avant et pendant la grossesse mais aussi de traitements antibiotiques au cours des premiers mois de la vie est également reliée à un risque accru d’allergies au lait de vache (ALV) chez l’enfant [10]. Les données pouvant être utilisées pour caractériser le microbiote des patients présentant des AA sont encore préliminaires. Nous avons récemment décrit la dysbiose du MI chez des enfants souffrant d’une ALV médiée par les IgE. Les nourrissons avec ALV avaient des taux fortement réduits de Bifidobacteriaceae, Streptococcaceae, Enterobacteriaceae et Enterococcaceae ainsi que des taux beaucoup plus élevés de souches sélectionnées à partir des familles de Ruminococcaceae et de Lachnospiraceae. Le MI des sujets avec ALV comprenait 73 % de taxons de Firmicutes et Bacteroidetes qui sont également connus pour dominer l’intestin adulte [11].
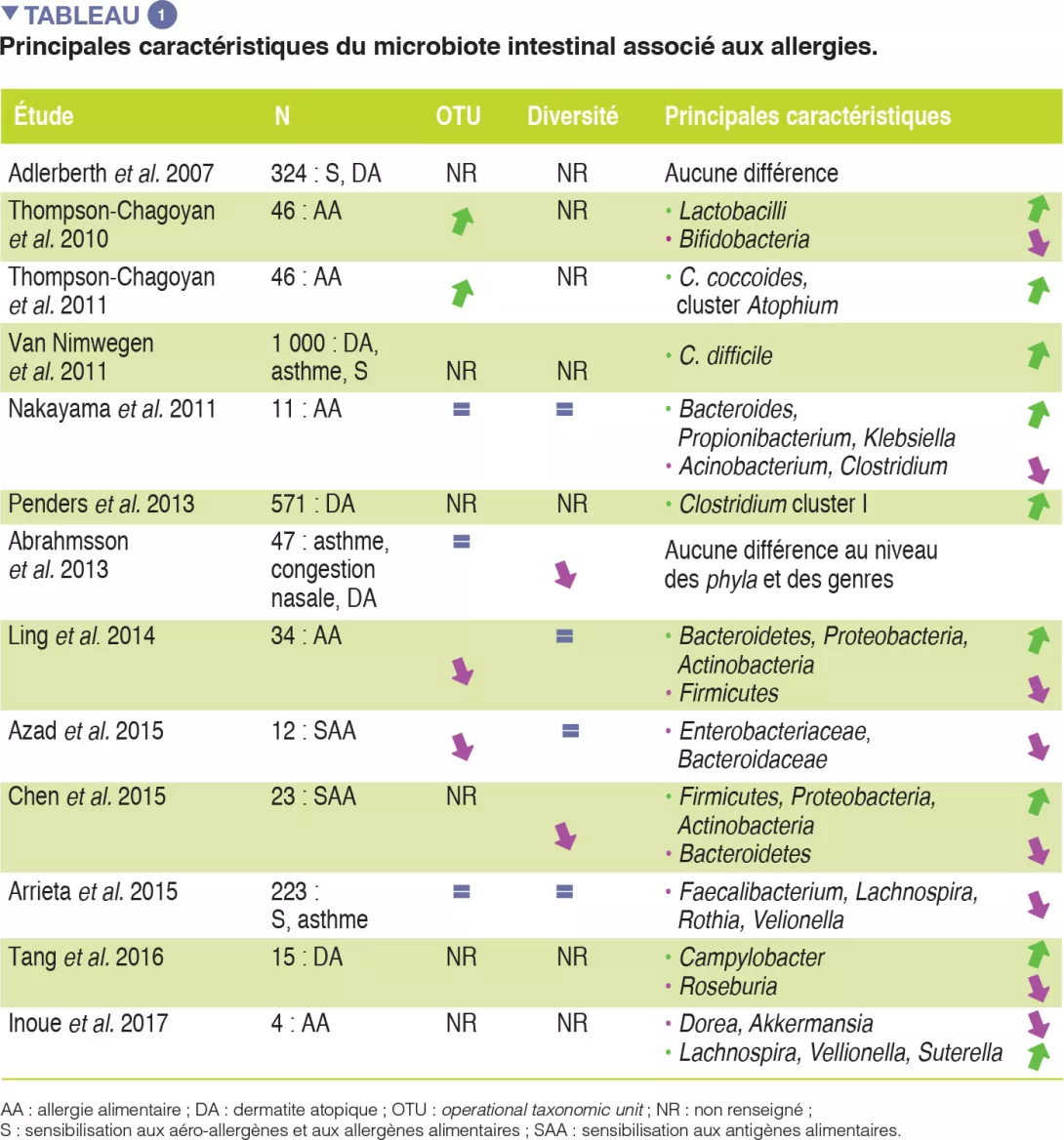
Bien que des preuves convaincantes d’une association entre la dysbiose du MI et les AA apparaissent, l’hétérogénéité des plans d’étude (impliquant les temps de prélèvement, les méthodes utilisées pour caractériser le microbiote et les phénotypes allergiques étudiés) rend difficile l’établissement d’une relation causale entre des taxons bactériens spécifiques et le développement d’allergies. Aucun d’entre eux n’a été associé de manière systématique aux AA, or un large éventail de microbes isolés de l’intestin humain pourrait être impliqué dans des mécanismes tolérogènes. Les principaux travaux étayant une association entre le MI et les allergies sont résumés dans le tableau I.
MI : une mission centrale dans la pathogenèse des allergies
Des données suggèrent que l’axe MI-épigénétique, modulé par un ensemble de facteurs alimentaires et environnementaux, joue un rôle décisif dans la survenue des allergies. Cet axe régule une pluralité de mécanismes tolérogènes immunitaires mais aussi non immunitaires et pourrait être la cible idéale de stratégies innovantes, préventives et thérapeutiques pour lutter contre les allergies.
Les AGCC sont les principaux métabolites du MI impliqués dans les interactions avec les cellules humaines. Parmi ceux-ci, le butyrate exerce un rôle central dans l’induction de la tolérance immunitaire, et un déficit en butyrate a été remarqué chez des patients allergiques [4]. On peut supposer que les différents types de dysbiose entraînent des effets similaires en termes d’AGCC et/ou que la production d’autres métabolites dérivés du microbiote peut faciliter la survenue d’allergies. Les espèces du genre Clostridium, qui appartiennent aux groupes IV et XIVa, sont la principale source d’AGCC dans le côlon. Les AGCC produits par les bactéries ont été impliqués dans la régulation de la proportion et de la capacité fonctionnelle des Treg qui, dans certaines études, ont été spécifiquement attribués à la production de butyrate par les Clostridiales sporogènes. Un enrichissement des taxons de la classe des Clostridia et du phylum des Firmicutes a été observé chez des sujets humains présentant une résolution de l’ALV [9]. Les données issues de notre laboratoire ont mis en évidence qu’un traitement oral par butyrate entraîne une inhibition importante de la réponse allergique aiguë, de la peau et des scores, des symptômes anaphylactiques ainsi qu’une réduction de la température corporelle, une augmentation de la perméabilité intestinale et la production de lactoglobuline anti-βLG (BLG), d’IgE, d’interleukine 4 (IL-4) et d’IL-10 dans un modèle murin d’ALV, ce qui suggère un rôle protecteur de cet AGCC contre les AA [9]. Le butyrate présente de multiples mécanismes d’action. Toutefois, beaucoup d’entre eux impliquent une régulation épigénétique de l’expression génique via l’inhibition de l’histone désacétylase (HDAC). L’inhibition des HDAC9 et 6 augmente l’expression du gène FoxP3 ainsi que la production et la fonction suppressive des Treg [12]. Nous avons évalué les effets directs du butyrate sur les cellules mononucléées du sang périphérique (PBMC) d’enfants souffrant d’une ALV médiée par les IgE. Les PBMC ont été stimulées par la BLG en présence ou en l’absence de cet AGCC. Les résultats préliminaires révèlent que le butyrate active la production d’IL-10 ainsi que d’interféron γ et diminue le taux de méthylation de l’ADN de ces deux cytokines. La même dose efficace de cet AGCC induit une déméthylation de la région du promoteur de FoxP3 et réduit l’expression de l’HDAC6 et l’HDAC9 [2].
Modulation du microbiote intestinal associé aux allergies
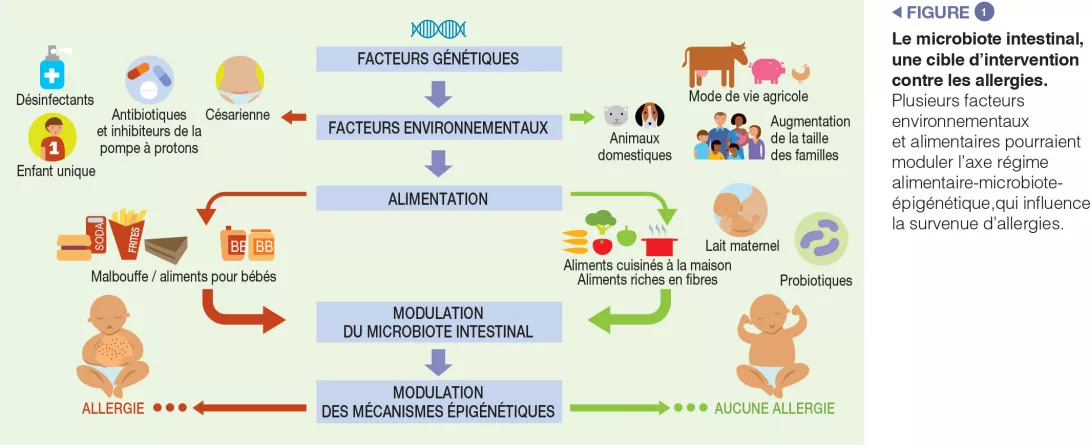
Les enfants exposés à des environnements agricoles ont un risque plus faible de développer des allergies. Même si cela n’a pas été prouvé de manière concluante, l’une des explications plausibles de cet effet protecteur lié à une exposition tôt dans la vie est le rôle du MI car les personnes exposées à cet environnement possèdent une composition microbienne différente de celles exposées à d’autres modes de vie [3]. D’autres facteurs épidémiologiques protègent contre les AA : une fratrie plus âgée et une exposition aux animaux domestiques dès le début de la vie. Le fait d’avoir des animaux de compagnie est relié à une forte diversité microbienne dans l’environnement domestique. Une étude récente évaluant l’incidence des habitudes alimentaires sur le développement des AA à l’âge de 2 ans suggère que celles-ci peuvent influer sur le développement des AA en modifiant la composition du MI. En particulier, un régime alimentaire ayant une forte teneur en fruits, légumes et aliments préparés à la maison a été associé à moins d’AA chez le nourrisson [9] (Figure 1).
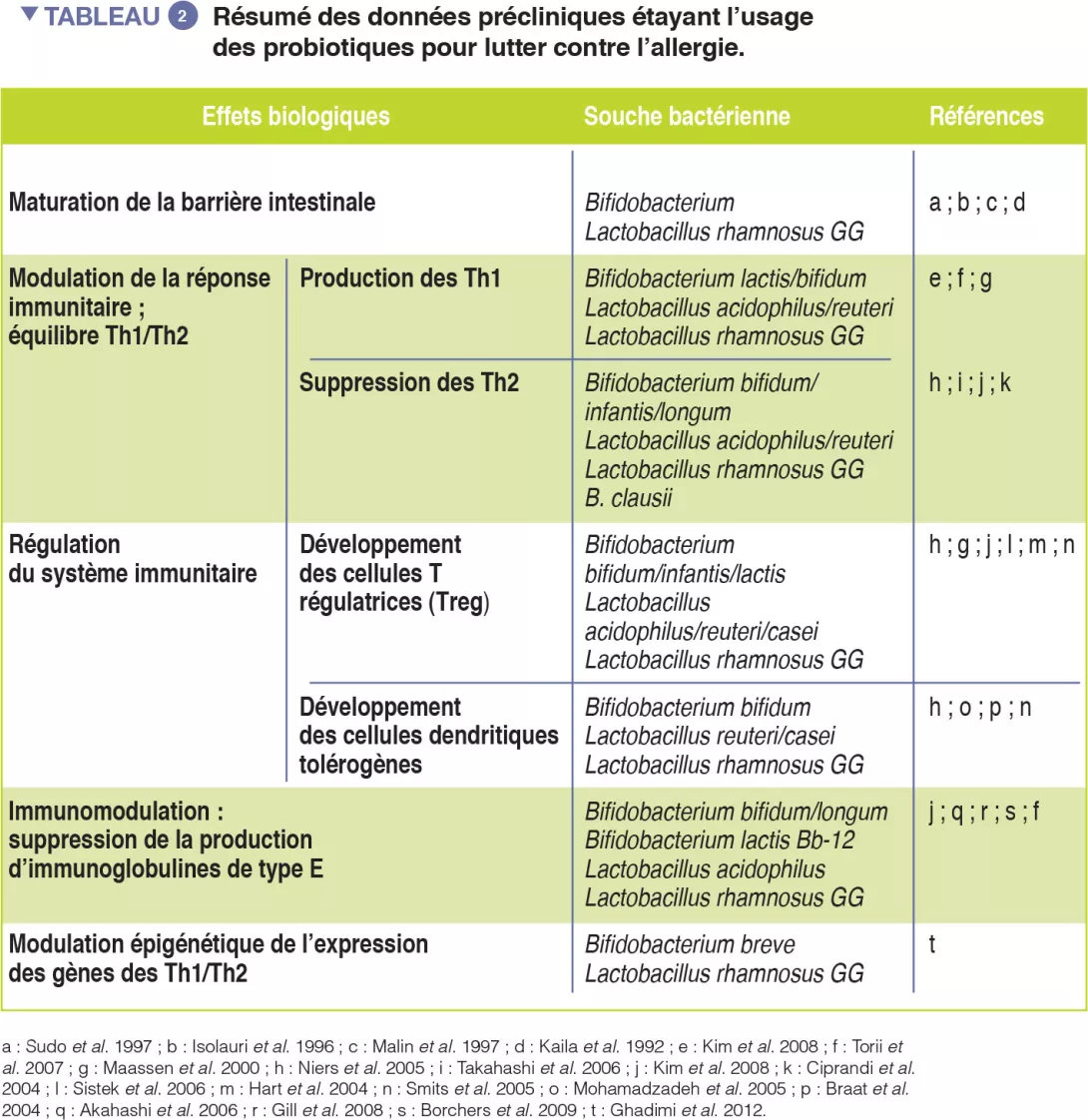
Les probiotiques (microbes ingérés apportant des bienfaits sur la santé de l’hôte) peuvent être bénéfiques car ils modulent le MI [13]. Les données étayant l’usage des probiotiques pour lutter contre les allergies respiratoires sont encore préliminaires (Tableau 2). Néanmoins, des métaanalyses ont révélé que l’utilisation, de la grossesse jusqu’aux 6 premiers mois de la vie, de probiotiques sélectionnés pourrait réduire l’incidence de l’eczéma atopique chez les enfants ayant des antécédents familiaux de maladie allergique [14].
Comment moduler le microbiote intestinal ?
De nouveaux travaux étayent l’usage de stratégies alimentaires et de souches probiotiques sélectionnées pour la prévention et le traitement des allergies (Tableau 2).
Nous avons précédemment démontré que l’ajout d’un probiotique, L. rhamnosus, à une formule hypo-allergénique accélère l’acquisition de la tolérance immunitaire et protège contre l’apparition d’autres manifestations atopiques chez les enfants qui présentent une ALV [15-17]. Lors d’une comparaison du microbiote fécal des nourrissons recevant ce traitement probiotique qui induit une tolérance, nous avons trouvé des corrélations positives significatives entre l’abondance des genres qui ont un potentiel à produire du butyrate et la concentration fécale de cet AGCC [11]. Des démarcations au niveau des souches pour les genres produisant du butyrate (y compris Roseburia, Coprococcus et Blautia), identifiées chez des nourrissons ayant acquis une tolérance au lait de vache, suggèrent que le traitement par L. rhamnosus contribue à l’acquisition d’une tolérance en altérant la structure de la communauté au niveau des souches des taxons qui présentent un potentiel à produire du l’AGCC [11]. Il a ainsi été montré que l’immunothérapie orale complétée par une autre souche de L. rhamnosus était efficace pour induire une non-réactivité aux arachides chez 82 % des enfants allergiques [18].
Conclusion
Les trillions de bactéries qui peuplent nos intestins régulent de manière critique les fonctions physiologiques clés qui permettent de lutter contre les allergies. Les modifications de la composition et de la fonction du MI induites par l’environnement (diminution de la production de butyrate, par ex.) créent une dysbiose, liée à un risque accru d’allergie. Comprendre comment ces communautés bactériennes interagissent avec le système immunitaire ouvrira la voie à de nouvelles stratégies préventives.






