Rôle de l’épithélium intestinal et de la réponse immunitaire innée
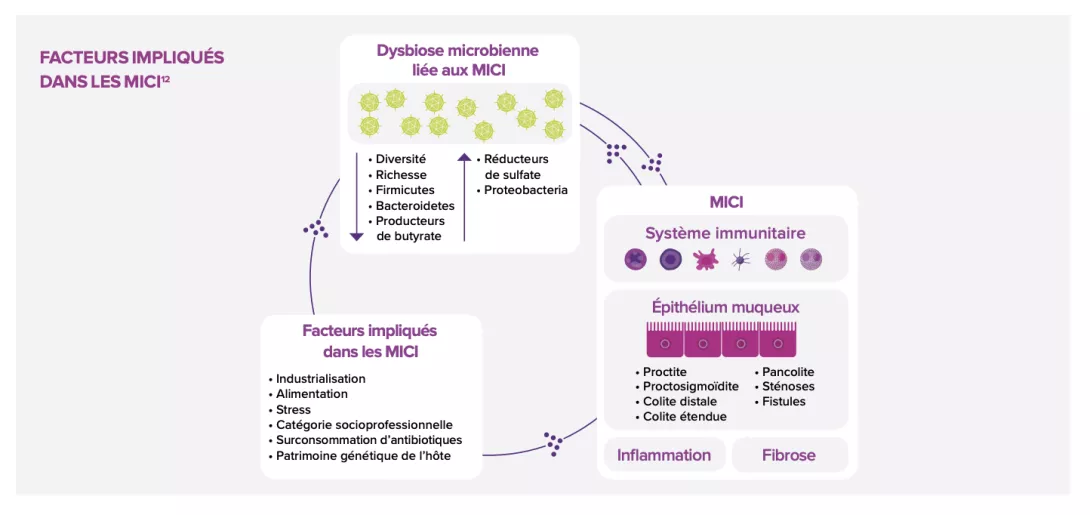
La dysbiose observée dans les MICI pourrait être liée à une altération de l’épithélium intestinal, devenu incapable de jouer son rôle de barrière, ainsi qu’à un dérèglement de la réponse immunitaire innée locale favorisant l’inflammation. Explications et zoom sur les peptides antimicrobiens suspectés d’y contribuer.
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
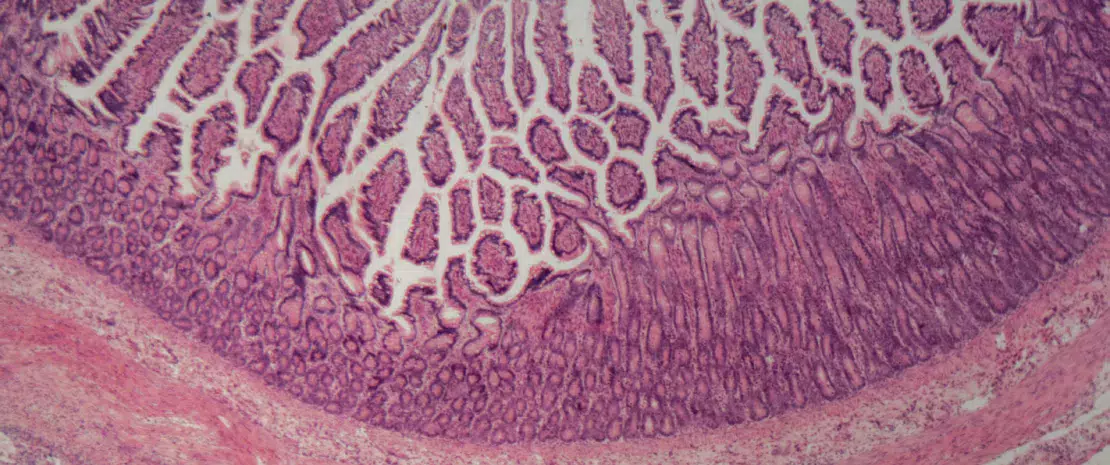
Intestinal epithelium
A propos de cet article
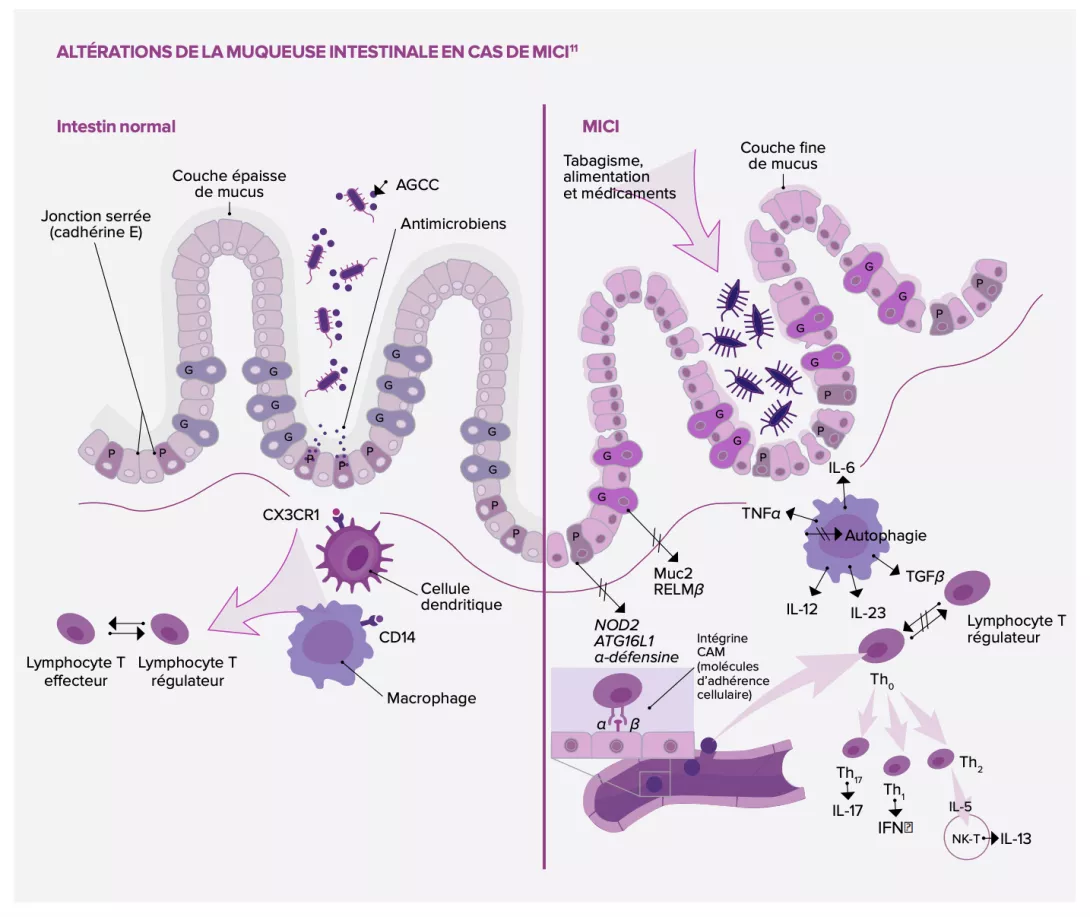
L’altération de la barrière intestinale observée chez les patients souffrant de MICI pourrait expliquer la physiopathologie de la dysbiose : non seulement cette frontière mécanique serait altérée, mais aussi sa première ligne de défense immunitaire. Outre son rôle dans l’absorption d’ions, d’eau et d’autres nutriments, la barrière intestinale sert de rempart et empêche l’entrée de bactéries dans la lumière intestinale.
Or sa perméabilité augmente lors des phases aiguës de maladie de Crohn (MC), ce qui favorise la translocation de bactéries à travers la muqueuse et l’inflammation locale5.
Le rôle de la barrière intestinale
Possiblement en cause : l’altération des jonctions serrées des cadhérines de l’épithélium intestinal (des glycoprotéines jouant un rôle-clé dans l’adhérence intercellulaire) ; l’implication de certains facteurs de transcription11 liés à la régénération épithéliale. Les autres mécanismes évoqués concernent le mucus intestinal, dont l’épaisseur maintient les bactéries pathogènes à distance et qui s’avère considérablement amoindrie chez les patients MICI. Le phénomène s’expliquerait par l’altération des cellules caliciformes, productrices de mucus, dont la perturbation induit le développement de colites sur des modèles murins ; il s’expliquerait également chez les malades MC par le dysfonctionnement des cellules de Paneth, situées au fond des cryptes de l’intestin grêle, réputées participer à l’homéostasie et au rôle de défense de la muqueuse intestinale via la sécrétion d’antimicrobiens5,11.
Première ligne de défense du système immunitaire
La littérature évoque par ailleurs plu- sieurs mécanismes mettant en jeu l’immunité innée, et plus précisément les cellules dendritiques, les macro- phages, les cellules lymphoïdes in- nées et les neutrophiles. Ces cellules, qui complètent le dispositif évoqué plus haut, agissent en tant que pre- mière ligne de défense du système immunitaire. Dans l’intestin des su- jets sains, les macrophages sont en état d’hyporéactivité (prolifération et activité réduites) et peuvent produire des cytokines anti-inflammatoires11. Chez le patient MICI en revanche, le déséquilibre des populations de cellules dédiées à l’immunité innée serait associé à plusieurs phénomènes11 : le franchissement de la muqueuse, devenue perméable, par des bactéries du fait d’une atténuation de l’activité des macrophages et d’un défaut de recrutement des neutrophiles ; une inflammation induite par la production de grandes quantités de cytokines pro-inflammatoires (TNF-α et IL-6) par des macrophages spécifiques ; et enfin le recrutement de lymphocytes T inflammatoires via une accumulation de cellules dendritiques, qui induisent la réponse immunitaire adaptative.