Microbiote et maladie Cœliaque
Synthèse
Par le Pr. Elena F. Verdu
Farncombe Family Digestive Health Research Institute, Université McMaster, Hamilton, Canada
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Des facteurs environnementaux seraient impliqués dans la pathogenèse de la maladie cœliaque (MC), une maladie auto-immune déclenchée par l’ingestion de gluten. Des études cliniques montrent des altérations de la composition du microbiote chez les patients atteints de MC. Même si certaines caractéristiques constantes ont été mises en évidence dans les différentes études réalisées, aucune signature microbienne de cette maladie n’a été identifiée. À l’aide de modèles animaux gnotobiotiques* et réductionnistes, une récente étude a suggéré que les souches bactériennes provenant de patients ayant une MC pouvaient avoir un potentiel pathogène ou inflammatoire plus important. La modulation du microbiote avec des probiotiques spécifiques, permettant de modifier certains mécanismes pathogènes essentiels à la maladie cœliaque, pourrait constituer une approche thérapeutique intéressante en complément du régime sans gluten.
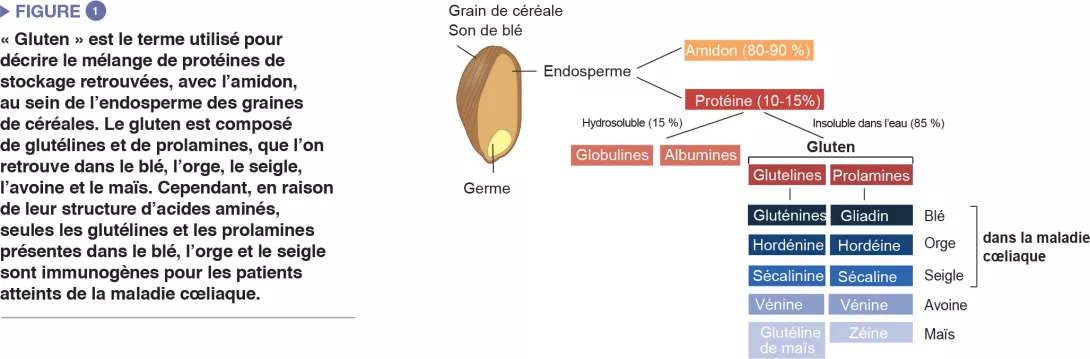
La maladie cœliaque est une réaction inflammatoire auto-immune fréquente, survenant chez les personnes génétiquement prédisposées, suite à la consommation de gluten (Figure 1). La lésion caractéristique est la destruction des villosités de la muqueuse de l’intestin grêle (entéropathie). Les manifestations cliniques de la maladie sont variées et incluent des symptômes intestinaux et extra-intestinaux. La MC est la seule maladie auto-immune dans laquelle l’antigène déclenchant (le gluten) est identifié. On connaît bien les mécanismes qui expliquent le risque génétique HLA et les étapes provoquées par le facteur alimentaire conduisant au développement de lymphocytes T pro-inflammatoires spécifiques au gluten et d’auto-anticorps (Figure 2). En revanche, on ignore pourquoi la prévalence de la maladie a rapidement augmenté ces dernières années et pourquoi la MC ne se développe que chez une fraction de personnes génétiquement prédisposées, suggérant l’implication d’autres facteurs génétiques ou environnementaux dans l’activation de la cascade inflammatoire. Le rôle des facteurs microbiens dans le développement de la maladie cœliaque fait notamment l’objet d’un intérêt croissant [1]. Dans cette revue, nous nous concentrons sur les altérations bactériennes et cherchons à déterminer leur rôle dans les mécanismes pathologiques ainsi que la manière dont elles pourraient constituer des cibles thérapeutiques potentielles.
Corrélation entre dysbiose et maladie cœliage : leçon des études cliniques
L’une des premières études à suggérer une contribution microbienne dans la MC décrivait la présence de bactéries en forme de bâtonnet dans les biopsies duodénales d’enfants nés pendant une « épidémie » de MC en Suède. Ces bactéries n’ont pas été observées chez les enfants non atteints ni chez ceux nés après l’épidémie. On a alors pensé que leur présence pouvait avoir contribué à l’augmentation de l’incidence de la maladie observée en Suède [2]. Cependant, on ignore toujours les mécanismes sous-tendant cette association.

Un certain nombre d’études publiées de- puis ont analysé la composition du microbiote présent dans le côlon et au niveau de l’intestin grêle chez des patients atteints de MC par rapport à des témoins sains. Certaines caractéristiques relativement constantes ont été mises en évidence dans les différentes études réalisées : des augmentations des proportions de Bacteroides et de membres du phylum des Proteobaceria, et des diminutions de Lactobacillus et de Bifidobacteria chez les patients cœliaques par rapport aux témoins [1]. Une abondance accrue de Proteobacteria a également été retrouvée chez des patients souffrant de symptômes persistants malgré un régime sans gluten [3]. Plus récemment, il a été montré que la composition du microbiote d’enfants présentant un risque génétique élevé de développer la maladie était différente de celle d’enfants présentant un risque génétique faible [4-6]. Enfin, il a été suggéré que les enfants à risque ayant développé la MC avaient une diversité microbienne initiale plus importante mais qui n’a pas augmenté avec l’âge, ce qui indiquerait une « maturation prématurée » du microbiote intestinal [7]. Les résultats laissent supposer que les modifications précoces du microbiote pourraient prédisposer à la maladie, mais des essais plus vastes portant sur des échantillons plus im-portants sont nécessaires pour confirmer ces observations. Néanmoins, aucune « signature microbienne » cœliaque n’a été établie. Les différences au niveau de la localisation des populations d’étude, du statut des sujets témoins, de l’origine des échantillons (selles vs intestin grêle) et de la méthodologie pourraient avoir contribué aux divergences constatées entre les études. Des observations contradictoires ont également été rapportées concernant les associations entre les événements pouvant altérer le développement du microbiote et le développement de la MC. Alors que les premières études suggéraient que l’utilisation d’antibiotiques et l’accouchement par césarienne pouvaient augmenter le risque de MC, des études cliniques plus récentes menées à plus grande échelle n’ont pas confirmé ces associations [8].
Le suivi à long terme des enfants à risque pourrait permettre de mieux comprendre les facteurs susceptibles de contribuer au déclenchement de la maladie. Malgré l’absence d’élément permettant d’établir un lien de causalité, ces associations cliniques ont stimulé l’étude des mécanismes fondamentaux en cause dans des systèmes réductionnistes et des modèles animaux.
Mécanismes microbiote-maladie cœliaque : que dit la recherche ?
Pour mieux comprendre comment les bactéries peuvent être impliquées dans la pathogenèse ou le développement de la MC, il faut étudier la fonction de la communauté microbienne chez des patients atteints de MC vs des sujets sains. L’isolement de bactéries provenant de l’intestin grêle humain permet une traduction en modèles réductionnistes. Par exemple, les souches d’Enterobacteriaceae isolées chez des patients cœliaques étaient plus virulentes que celles isolées chez les témoins sains [9]. De plus, les souches d’Escherichia coli isolées chez des enfants cœliaques avaient une plus grande capacité pro-inflammatoire in vitro que les souches de Bifidobacterium isolées chez les enfants sains [10]. L’introduction d’un microbiote d’origine humaine chez des souris axéniques* permet une comparaison in vivo des phénotypes induits. En outre, ces souris peuvent ex- primer les caractéristiques du système immunitaire humain (expression de la classe II du CMH par exemple) qui sont essentielles au développement de la maladie cœliaque. Des souris transgéniques exprimant HLA-DQ8, le gène du risque cœliaque chez l’homme, étaient protégées de la pathologie induite par le gluten quand elles étaient colonisées de façon minimale avec un microbiote dépourvu d’agents pathogènes ou de bactéries opportunistes. Cependant, si une souche adhérente d’E. coli, isolée dans l’intestin cœliaque, était ajoutée aux bactéries protectrices, les souris développaient la pathologie induite par le gluten. De manière similaire, le traitement antibiotique par vancomycine de souris possédant un microbiote murin diversifié a entraîné une augmentation de Proteobacteria, notamment d’E. coli, et une aggravation de la pathologie induite par le gluten [11].
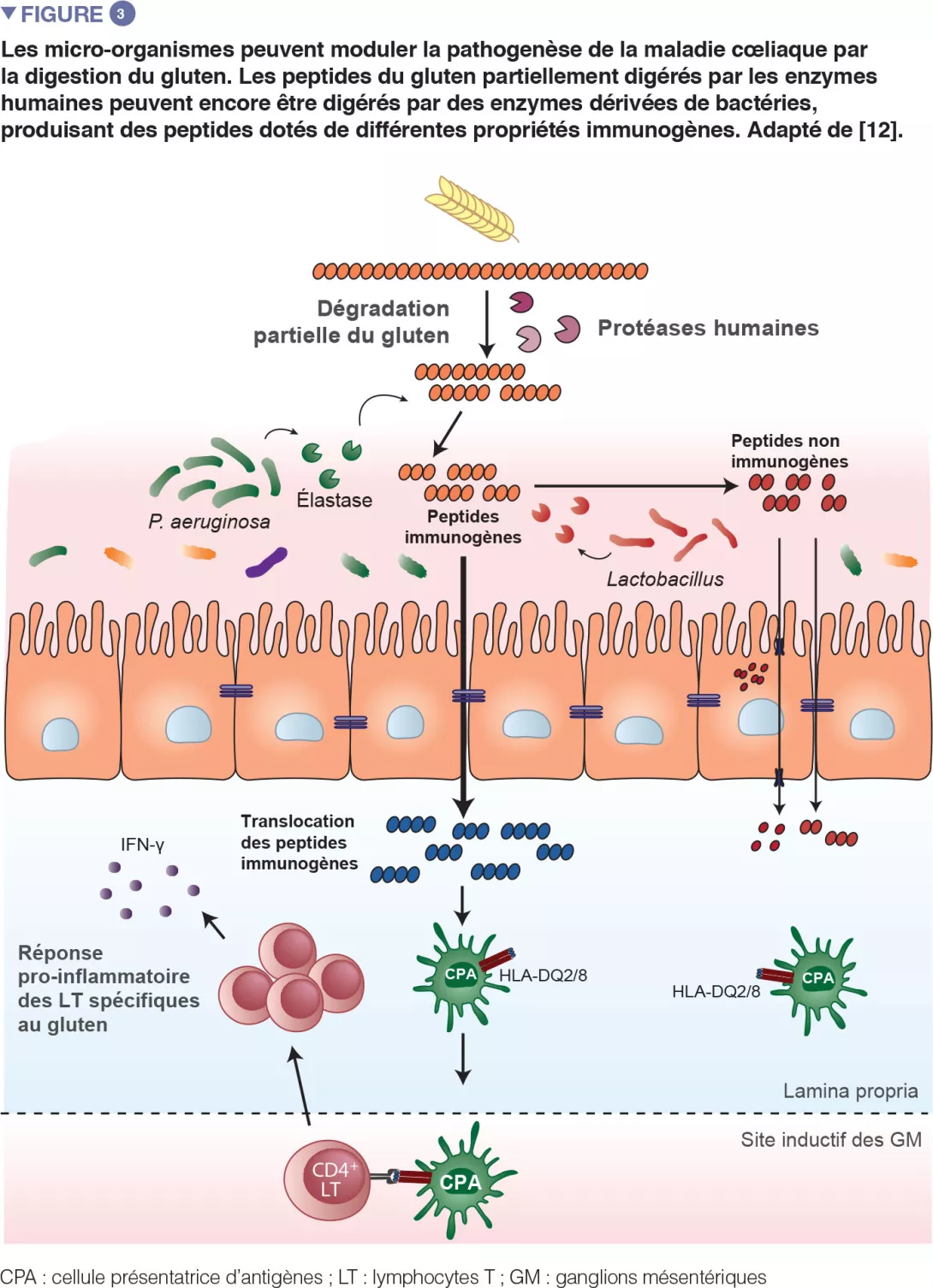
De récents travaux translationnels conduits chez la souris ont réitéré l’observation selon laquelle des bactéries sont capables de dégrader le gluten (Figure 3). Cette étude a été réalisée avec des souris gnotobiotiques colonisées avec des agents pathogènes opportunistes, comme Pseudomonas aeruginosa, ou avec des commensaux, comme Lactobacillus. Les auteurs ont montré que différentes bactéries peuvent dégrader le gluten in vivo, mais que les fragments protéiques qu’elles produisent sont distincts. Cette étude a également démontré que les enzymes issues de P. aeruginosa, isolée chez un patient cœliaque, pouvaient dégrader le gluten. Ce processus de digestion a produit des fragments de gluten qui ont stimulé une réponse immunitaire inflammatoire dans les cellules isolées chez les patients atteints de la MC et qui étaient davantage capables de franchir la barrière de l’intestin grêle, siège de l’interaction avec les cellules immunitaires. Plusieurs peptides générés par la digestion de P. aeruginosa et ultérieurement digérés avec des lactobacilles, isolés chez un sujet sain et constituant un élément central du microbiome sain, n’induisaient plus de réponses immunitaires inflammatoires in vitro. Cette étude a mis en évidence le fait que les agents pathogènes opportunistes, mais aussi les commensaux, peuvent modifier le répertoire et les propriétés immunitaires des peptides du gluten dans l’intestin, impactant ainsi la prédisposition à la maladie [12].
Les micro-organismes peuvent-ils être utilisés pour traiter ou prévenir la maladie cœliaque
Un diagnostic de MC implique l’éviction stricte à vie de tout aliment contenant du gluten parce qu’une exposition à des quantités, même faibles, peut déclencher toute une variété de symptômes et une entéropathie chez les personnes touchées. Le gluten est omniprésent dans les aliments transformés, d’où la difficulté d’une observance stricte et le développement de recherches visant à trouver des traitements alternatifs ou adjuvants. Compte tenu du rôle clé des micro-organismes dans la régulation de l’immunité et de l’association entre MC et altération de la composition et de la fonction du microbiote, le potentiel thérapeutique de différents probiotiques a été testé. Une souche de Bifidobacterium longum, qui a précédemment démontré des effets anti-inflammatoires in vitro [10- 13], a été testée chez des enfants suivant un régime sans gluten dans le cadre d’un essai contrôlé vs placebo en double aveugle.
Métabolisme du gluten par les bactéries
-
Le gluten est très résistant à la dégradation par les enzymes digestives de l’hôte dans l’intestin grêle en raison de sa structure d’acides aminés
-
Il reste alors de gros fragments de gluten capables d’induire des réponses immunitaires une fois qu’ils ont franchi la barrière épithéliale chez les personnes génétiquement prédisposées
-
Le tractus gastro-intestinal contient des bactéries capables de dégrader le gluten, et ces bactéries peuvent différer entre les patients atteints de la maladie cœliaque et le sujet sain [17]
L’administration du probiotique a produit des modifications immunitaires, ainsi que des taux plus faibles de bactéries potentiellement nocives (B. fragilis). Cependant, aucune modification des symptômes n’a été observée chez les enfants qui ont reçu le probiotique par rapport à ceux ayant reçu le placebo [14]. Comme le probiotique a été administré avec le régime sans gluten, il est difficile de faire la distinction entre les effets induits par la restriction alimentaire et ceux provoqués par le probiotique. Deux autres études ont testé les effets d’une souche de Bifidobacterium infantis. Le premier essai randomisé contrôlé vs placebo en double aveugle a démontré que les patients recevant le probiotique présentaient une amélioration significative des symptômes après 3 semaines, mais aucune différence n’a été constatée au niveau de la perméabilité intestinale [15]. Un essai de suivi visait à déterminer si le même probiotique pouvait moduler les réponses immunitaires innées, qui pourraient être responsables de l’amélioration des symptômes précédemment observée. L’administration d’une souche de B. infantis a produit une diminution du nombre de cellules de Paneth dans l’intestin grêle, en parallèle à une diminution des peptides antimicrobiens. Ces effets du probiotique étaient indépendants du régime sans gluten [16]. Compte tenu du faible nombre de patients inclus à ces études, aucun élément à ce jour ne permet de recommander un probiotique en particulier dans la MC. De plus, les probiotiques consommés par les patients cœliaques doivent être rigoureusement certifiés sans gluten, ce qui n’est pas le cas de toutes les préparations en vente libre. Avant toute consommation par le patient, nous devons mieux comprendre les mécanismes d’action, et ceux choisis en vue de tests complémentaires doivent être sélectionnés sur la base de leur implication dans les voies de la MC. Par exemple, les bactéries qui aident à la détoxification du gluten pourraient être sélectionnées et utilisées pour compléter le régime sans gluten. Cependant, à ce jour, aucune des bactéries testées n’a montré une digestion optimale du gluten in vitro. Les études réalisées se sont concentrées sur les souches bactériennes produisant des enzymes capables de dégrader le gluten, mais des espèces fongiques comme Aspergillus niger produisent également des enzymes dégradant le gluten, et des combinaisons rationnelles d’organismes fongiques et bactériens pourraient offrir un axe intéressant de recherche thérapeutique dans la MC.
Conclusion
Le rôle du microbiote intestinal dans la MC est désormais évident. Au-delà des associations cliniques, des systèmes réductionnistes et des modèles animaux gnotobiotiques ont montré que des micro-organismes spécifiques pouvaient moduler des étapes clés dans la pathogenèse de la maladie cœliaque. L’utilisation de ces systèmes pour étudier les interactions spécifiques micro-organismes-hôte et micro-organismes-gluten et des études cliniques plus vastes impliquant le suivi des personnes à risque sont essentielles pour comprendre comment les micro-organismes peuvent déclencher la maladie. Cela pourrait permettre de mettre au point des stratégies préventives ciblées sur les micro-organismes ou des traitements adjuvants au régime sans gluten.