Microbiota y enfermedad celíaca
Síntesis
Por la Pr. Elena F. Verdu
Instituto de Investigación de la Salud Digestiva de la Familia Farncombe, Universidad McMaster, Hamilton, Canadá
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Autor
Se cree que puede haber factores medioambientales implicados en la patogenia de la enfermedad celíaca (EC), una enfermedad autoinmune desencadenada por la ingesta de gluten. Hay estudios clínicos que demuestran alteraciones de la composición de la microbiota en los pacientes afectados por la EC. A pesar de que se hayan evidenciado algunas características constantes en los diferentes estudios realizados, no se ha identificado una firma microbiana de esta enfermedad. Con ayuda de modelos animales gnotobióticos* y reduccionistas, un reciente estudio sugiere que las cepas bacterianas provenientes de pacientes con una EC podrían tener un potencial patógeno o inflamatorio más importante. La modulación de la microbiota con probióticos específicos, que permite modificar ciertos mecanismos patógenos esenciales de la enfermedad celíaca, podría constituir un enfoque terapéutico interesante como complemento de una dieta sin gluten.
La enfermedad celíaca es una reacción inflamatoria autoinmune frecuente, que se manifiesta en personas genéticamente predispuestas, tras un consumo de gluten (Figure 1). La lesión característica es la destrucción de las vellosidades de la mucosa del intestino delgado (enteropatía). Las manifestaciones clínicas de la enfermedad son variadas, e incluyen síntomas intestinales y extraintestinales. La EC es la única enfermedad autoinmune en la que se ha identificado el antígeno desencadenante (el gluten). Se conocen bien los mecanismos que explican el riesgo genético HLA y las etapas provocadas por el factor alimenticio que conducen al desarrollo de linfocitos T proinflamatorios específicos del gluten y de autoanticuerpos (Figure 2). En cambio, se desconoce por qué la prevalencia de la enfermedad ha aumentado rápidamente en los últimos años y por qué la EC solo se desarrolla en una fracción de personas genéticamente predispuestas, lo que hace pensar en una implicación de otros factores genéticos o medioambientales en la activación de la cascada inflamatoria. El papel de los factores microbianos en el desarrollo de la enfermedad celíaca ha sido objeto de un interés creciente [1]. En esta revisión, nos concentramos en las alteraciones bacterianas y queremos determinar su función en los mecanismos patológicos, así como la manera en que podrían llegar a ser objetivos terapéuticos potenciales.
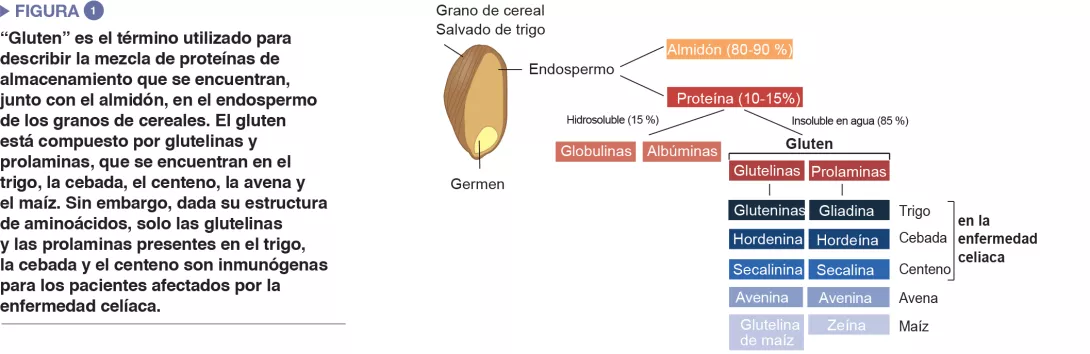
Correlación entre disbiosis y enfermedad celíaca: lecciones de los estudios clínicos
Uno de los primeros estudios que sugirió una contribución microbiana en la EC describía la presencia de bacterias en forma de bastoncillo en las biopsias duodenales de niños nacidos durante una “epidemia” de EC en Suecia. Estas bacterias no se observaron en los niños no afectados ni en los nacidos después de la epidemia. Por ello, se pensó que su presencia podría haber contribuido al aumento de la incidencia de la enfermedad observada en Suecia [2]. Sin embargo, a día de hoy todavía se ignoran los mecanismos que sustentan esta asociación.
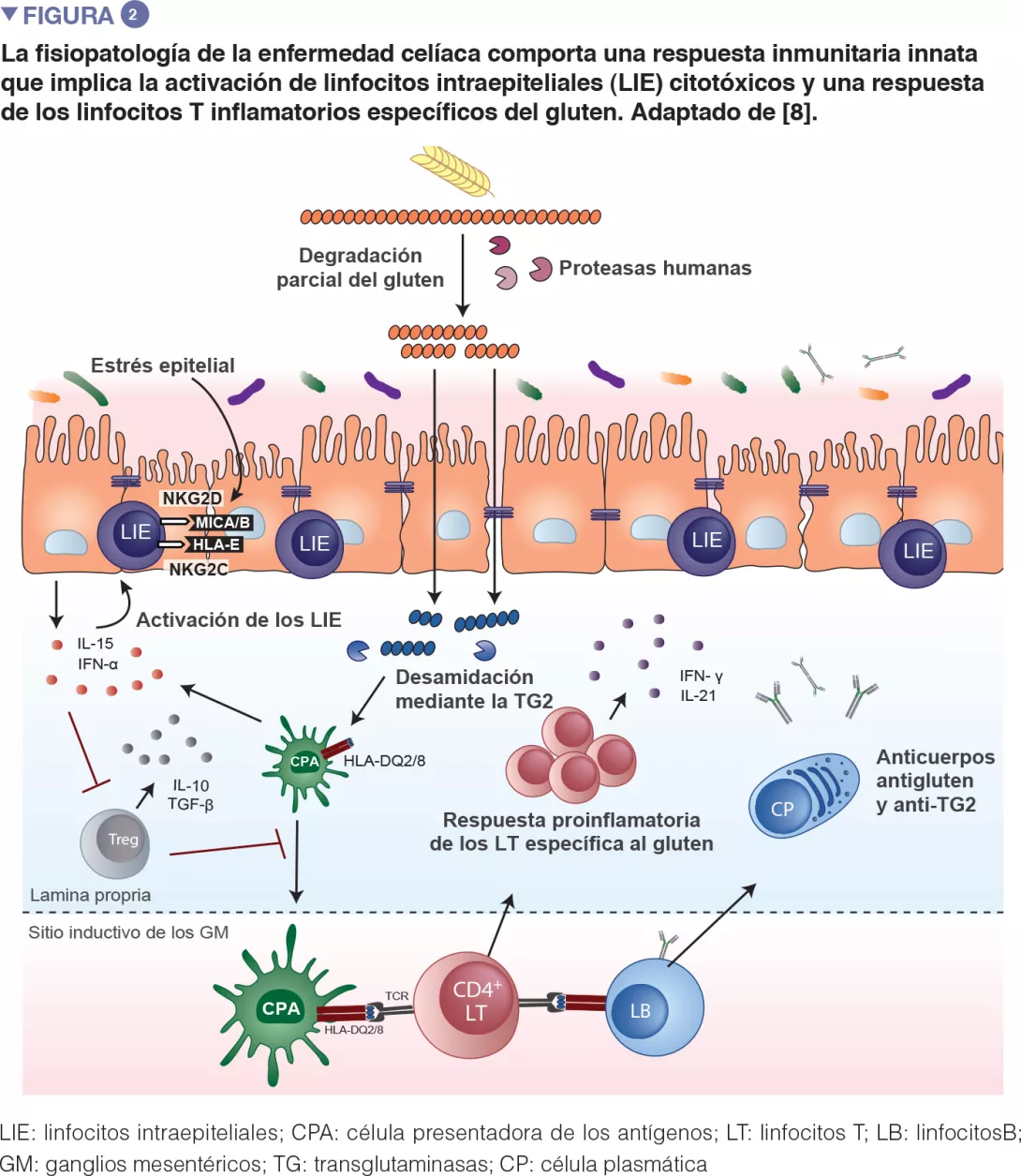
Un cierto número de estudios publicados desde entonces ha analizado la composición de la microbiota presente en el colon y en el intestino delgado en pacientes afectados por EC, en comparación con pacientes control sanos. Se han evidenciado algunas características relativamente constantes en los diferentes estudios realizados: aumento de las proporciones de Bacteroides y de miembros del filo de Proteobacteria, y disminución de Lactobacillus y de Bifidobacteria en los pacientes celíacos respecto de los sanos [1]. En pacientes que sufrían síntomas persistentes a pesar de una dieta sin gluten- también se ha hallado una mayor abundancia de Proteobacteria [3]. Más recientemente, se ha demostrado que la composición de la microbiota de niños que presentan un riesgo genético elevado de desarrollar la enfermedad es diferente de la de niños que presentan un riesgo genético bajo [4-6]. Por último, se ha sugerido que los niños con riesgo que desarrollaron la EC tenían una diversidad microbiana inicial más importante pero que no aumentó con la edad, lo que indicaría una “maduración prematura” de la microbiota intestinal [7].
Los resultados permiten su la microbiota podrían predisponer a la enfermedad, pero se necesitan estudios más amplios, con muestras más importantes, para confirmar estas observaciones. Sin embargo, no se ha establecido ninguna “firma microbiana” celíaca. Las diferencias en cuanto a la localización de las poblaciones de estudio, al estado de los sujetos sanos control, al origen de las muestras (heces, o bien, intestino delgado) y a la metodología, podrían haber contribuido a las divergencias constatadas entre los estudios. Asimismo, se han constatado observaciones contradictorias en cuanto a las asociaciones entre los eventos que podrían alterar el desarrollo de la microbiota y el desarrollo de la EC. Mientras que los primeros estudios sugerían que la utilización de antibióticos y el parto por cesárea podían aumentar el riesgo de EC, estudios clínicos más recientes realizados a mayor escala no han confirmado estas asociaciones [8]. El seguimiento a largo plazo de niños con riesgo podría permitir comprender mejor los factores susceptibles de contribuir al desencadenamiento de la enfermedad. A pesar de la ausencia de un elemento que permita establecer un vínculo de causalidad, estas asociaciones clínicas han estimulado el estudio de los mecanismos fundamentales implicados en sistemas reduccionistas y modelos animales.
Mecanismos microbiota - enfermedad celíaca: ¿qué dicen las investigaciones?
Para comprender mejor cómo pueden estar implicadas las bacterias en la patogenia o el desarrollo de la EC, hay que estudiar la función de la comunidad microbiana en pacientes afectados por EC y compararla con la de personas sanas. El aislamiento de bacterias provenientes del intestino delgado humano permite una traducción en modelos reduccionistas. Por ejemplo, las cepas de Enterobacteriaceae aisladas en pacientes celíacos eran más virulentas que las aisladas en los sujetos sanos [9]. Además, las cepas de Escherichia coli aisladas en niños celíacos tenían una mayor capacidad proinflamatoria in vitro que las cepas de Bifidobacterium aisladas en niños sanos [10]. La introducción de una microbiota de origen humano en ratones axénicos* permite una comparación in vivo de los fenotipos inducidos. Además, estos ratones pueden expresar las características del sistema inmunitario humano (expresión de la clase II del CMH, por ejemplo) que son esenciales para el desarrollo de la enfermedad celíaca. Ratones transgénicos que expresaban HLA-DQ8, el gen del riesgo celíaco en el hombre, estaban protegidos de la patología inducida por el gluten cuando eran colonizados mínimamente con una microbiota desprovista de agentes patógenos o de bacterias oportunistas. Sin embargo, si se añadía una cepa adherente de E. coli aislada en el intestino celíaco, a las bacterias protectoras, los ratones desarrollaban la patología inducida por el gluten. De manera similar, el tratamiento antibiótico por vancomicina en ratones que tenían una microbiota propia diversificada provocaba un aumento de Proteobacteria, en concreto de E. coli, y una exacerbación de la patología inducida por el gluten [11].
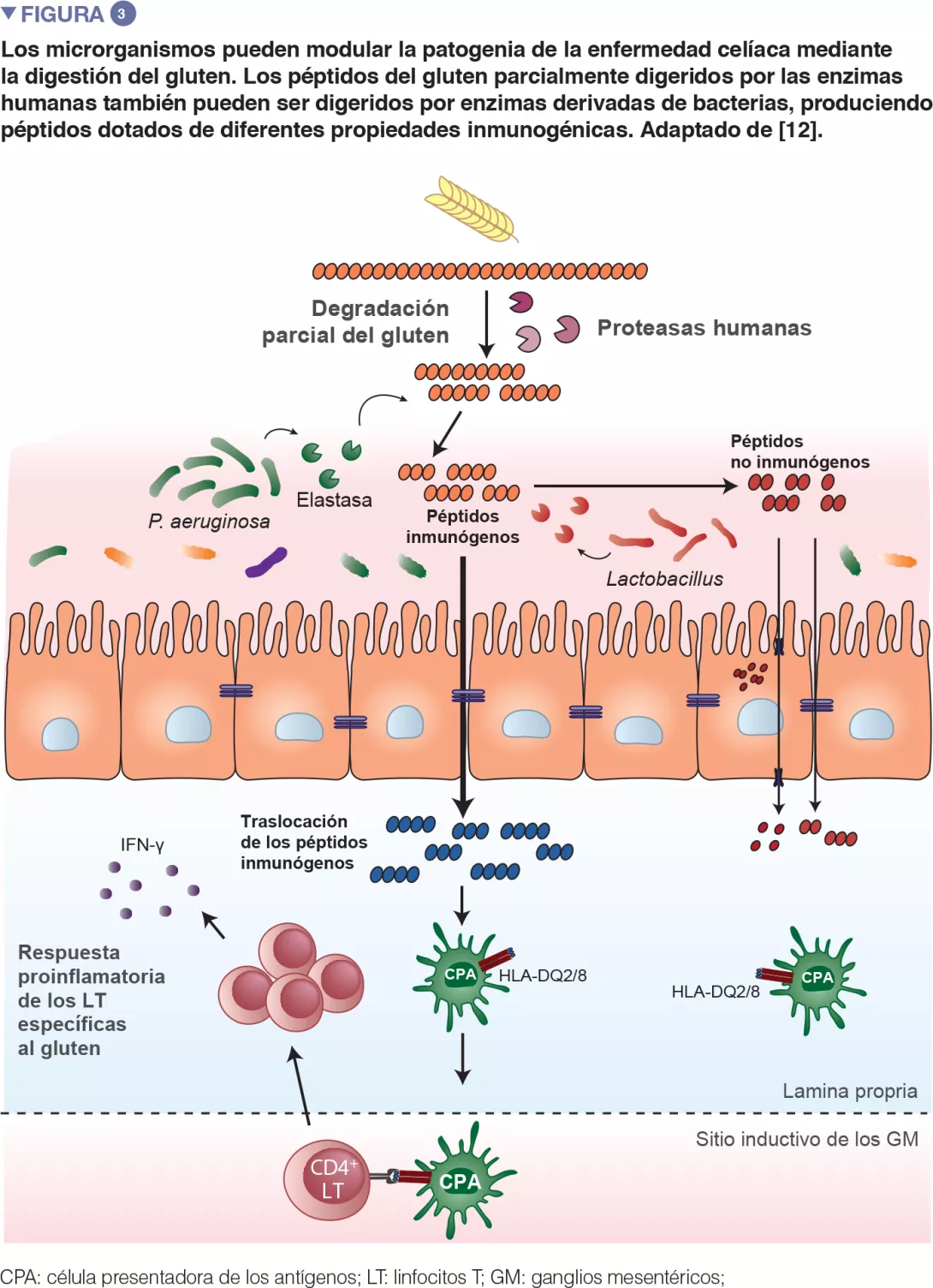
Recientes trabajos traslacionales reali- zados en ratones han reiterado la obser- vación según la cual las bacterias son ca- paces de degradar el gluten (Figure 3). Este estudio se ha realizado con ratones gnotobióticos colonizados con agentes patógenos oportunistas, como Pseudomo- nas aeruginosa, o con comensales, como Lactobacillus. Los autores han mostra- do que hay diferentes bacterias que pue- den degradar el gluten in vivo, pero que los fragmentos proteicos que producen son distintos. Este estudio también ha de- mostrado que las enzimas derivadas de P. aeruginosa, aislada en un paciente celíaco, podían degradar el gluten. Este proceso de digestión ha producido frag- mentos de gluten que han estimulado una respuesta inmunitaria inflamatoria en las células aisladas en pacientes afectados por la EC, y que tenían más capacidad de superar la barrera del intestino delgado, lugar donde se da la interacción con las células inmunitarias. Varios péptidos gene- rados por la digestión de P. aeruginosa y posteriormente digeridos con lactobacilos, aislados en un individuo sano, y que consti- tuían un elemento principal del microbioma sano, ya no inducían respuestas inmunita- rias inflamatorias in vitro. Este estudio ha puesto de relieve que los agentes patóge- nos oportunistas, pero también los comen- sales, pueden modificar el repertorio y las propiedades inmunitarias de los péptidos del gluten en el intestino, impactando así en la predisposición a la enfermedad [12].
¿Se pueden utilizar microorganismos para tratar o prevenir la enfermedad celíaca?
Un diagnóstico de EC implica evitar de forma estricta y de por vida cualquier alimento que contenga gluten porque una exposición a cantidades, incluso bajas, puede desencadenar toda una variedad de síntomas y una enteropatía en las personas afectadas. El gluten es omnipresente en los alimentos transformados, de ahí la dificultad de un cumplimiento estricto y el desarrollo de investigaciones con el objetivo de encontrar tratamientos alterna- tivos o adyuvantes. Dada la función clave de los microorganismos en la regulación de la inmunidad y de la asociación entre EC y alteración de la composición y de la función de la microbiota, se ha puesto a prueba el potencial terapéutico de los dife- rentes probióticos. Se probó una cepa de Bifidobacterium longum, que previamente había demostrado efectos antinflamatorios in vitro [10-13], en niños que seguían un régimen sin gluten en el marco de un es- tudio controlado frente a placebo a doble ciego.
Metabolismo del gluten por parte de las bacterias
-
El gluten es muy resistente a la degradación por las enzimas digestivas del huésped en el intestino delgado, debido a su estructura de aminoácidos
-
Por ello quedan fragmentos grandes de gluten capaces de inducir respuestas inmunitarias una vez que han atravesado la barrera epitelial en las personas genéticamente predispuestas
-
El tracto gastrointestinal contiene bacterias capaces de degradar el gluten, y estas bacterias pueden diferir entre los pacientes afectados por la enfermedad celíaca y los individuos sanos [17]
La administración del probiótico produjo modificaciones inmunitarias, así como concentraciones más bajas de bac- terias potencialmente nocivas (B. fragilis). Sin embargo, no se observó ninguna modificación de los síntomas en niños que recibieron el probiótico respecto a los que recibieron el placebo [14]. Como el probiótico se administró con la dieta sin gluten, es difícil hacer la distinción entre los efectos inducidos por la restricción alimentaria y los provocados por el probiótico. Otros dos estudios analizaron los efectos de una cepa de Bifidobacterium infantis. El primer estudio aleatorizado frente a placebo a doble ciego demostró que los pacientes que recibían el probiótico presentaban una mejora significativa de los síntomas des- pués de 3 semanas, pero no se constató ninguna diferencia en cuanto a la permeabilidad intestinal [15]. Un estudio de seguimiento buscaba determinar si el mismo probiótico podía modular las respuestas inmunitarias innatas, que podrían ser las responsables de la mejora de los síntomas anteriormente observada. La administración de una cepa de B. infantis produjo una disminución del número de células de Paneth en el intestino delgado, paralelamente a una disminución de los péptidos antimicrobianos. Estos efectos del probiótico eran independientes de la dieta sin gluten [16]. Teniendo en cuenta el bajo número de pacientes incluidos en estos estudios, a día de hoy no hay ningún elemento que permita recomendar un probiótico en particular para la EC. Además, los probióticos consumidos por los pacientes celíacos deben estar rigurosamente certificados sin gluten, lo que no ocurre con todos los pre- parados de venta sin receta. Antes de que el paciente los consuma, debemos comprender mejor los mecanismos de acción, y los elegidos según los análisis complementarios se deben seleccionar según su implicación en las vías de la EC. Por ejemplo, las bacterias que ayudan a la destoxificación del gluten podrían seleccionarse y utilizarse para completar la dieta sin gluten.
Sin embargo, a día de hoy, ninguna de las bacterias examinadas ha mostrado una digestión óptima del gluten in vitro. Los estudios realizados se han concentrado en las cepas bacterianas que pro- ducen enzimas capaces de degradar el gluten, pero hay especies fúngicas como Aspergillus niger que también producen enzimas que degradan el gluten, y es posible que combinaciones racionales de organismos fúngicos y bacterianos pudieran ofrecer un eje interesante de investigación terapéutica sobre la EC.
Conclusión
La función de la microbiota intestinal en la EC es evidente en la actualidad. Más allá de las asociaciones clínicas, los sistemas reduccionistas y los modelos animales gnotobióticos han mostrado que microrganismos específicos podían modular etapas clave en la patogenia de la enfermedad celíaca. Para estudiar las interacciones específicas microrganismoshuésped y microrganismosgluten es necesario utilizar estos sistemas, y para comprender cómo los microorganismos pueden desencadenar la enfermedad se deben realizar estudios clínicos más amplios que impliquen un seguimiento de las personas de riesgo. Esto podría permitir diseñar estrategias preventivas dirigidas a los microrganismos o a tratamientos adyuvantes a una dieta sin gluten.








